2022.11.09 发布公告称:2022年Q3实现销售收入22.62亿元,YoY+135.16%,归母净利润-37.97亿元,YoY-34.46%,扣非后净利润-38.16亿元,YoY-52.23%,EPS -2.84元。研发费用24.99亿元,YoY+20.68%。
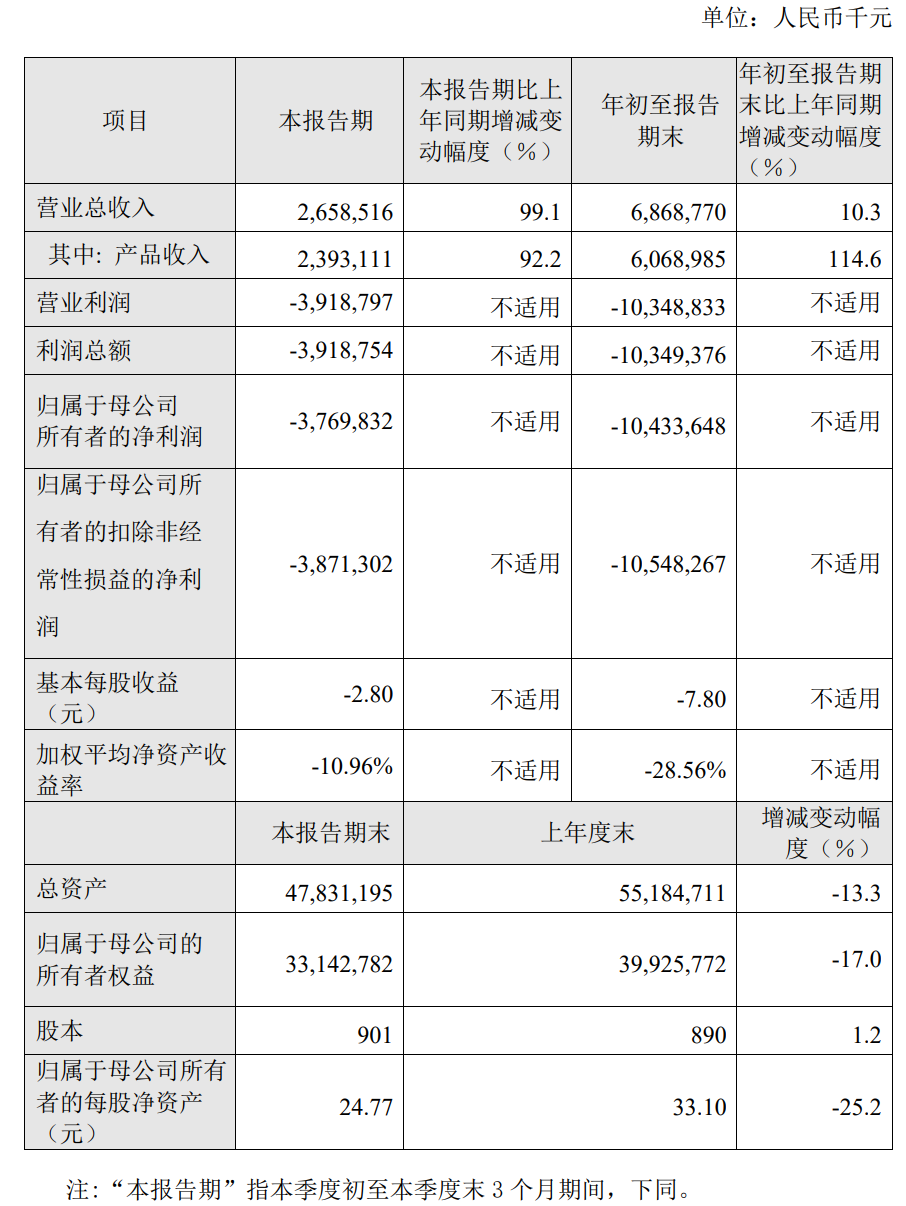
2022年第三季度公司产品收入为23.93亿元,较上年同比上升92.2%;2022年第三季
度公司营业总收入为26.59亿元,较上年同比上升99.1%。2022年前三季度公司产品收入
为60.69亿元,较上年同比上升114.6%;2022年前三季度公司营业总收入为68.69亿元,
较上年同比上升10.3%;2022年前三季度归属于母公司所有者的净亏损104.34亿元。
报告期末,公司总资产478.31亿元,较年初减少13.3%;归属于母公司的所有者权益
331.43亿元,较年初减少17.0%。
2022年第三季度产品收入为23.93亿元,上年同期产品收入为12.45亿元,产品收
入的增长主要得益于自主研发产品百悦泽®(泽布替尼胶囊)和百泽安®(替雷利珠
单抗注射液)以及安进公司授权产品的销售增长。2022年第三季度合作收入为2.66亿
元,主要来自于对与Novartis Pharma AG(以下简称“诺华制药”)分别于2021年第
一季度就PD-1抗体药物百泽安®获得的6.5亿美元合作预付款、2021年第四季度就
TIGIT抑制剂欧司珀利单抗(ociperlimab)的3亿美元合作预付款进行的部分收入确
认。上年同期合作收入为0.90亿元,主要来自于对诺华制药就百泽安®获得的合作预
付款进行的部分收入确认。
2022年第三季度,百悦泽®全球销售额总计10.65亿元,上年同期全球销售额总
计4.26亿元。在美国,百悦泽®销售额总计7.40亿元,上年同期美国市场销售额总计
2.18亿元,第三季度百悦泽®在美国销售的持续增长主要来自于美国处方数量的持续
增长以及临床医生在获批适应症中的使用增多,包括套细胞淋巴瘤(MCL)、华氏
巨球蛋白血症(WM)和边缘区淋巴瘤(MZL)。在中国,百悦泽®销售额总计2.70
亿元,上年同期中国市场销售额总计2.08亿元,本季度百悦泽®在中国销售的增长主
要得益于在包括复发/难治性慢性淋巴细胞白血病(CLL)、套细胞淋巴瘤(MCL)
和华氏巨球蛋白血症(WM)等多个已获批适应症的销售额的持续增长以及在中国
BTK抑制剂市场的领先地位。目前,百悦泽®在中国获批的三项适应症已全部进入国
家医保药品目录。
2022年第三季度,百泽安®在中国的销售额总计8.79亿元,上年同期中国市场销
售额总计4.98亿元。百泽安®在今年新增获批适应症推动了市场渗透率和市场份额的
提升,同时医保目录报销范围的扩大带来了更多的新患者需求。目前,百泽安®治疗
复发或难治性经典型霍奇金淋巴瘤(R/R cHL)、二线尿路上皮癌(UC)、一线非
鳞状非小细胞肺癌(NSCLC)、一线鳞状非小细胞肺癌(NSCLC)和二线或三线肝细胞癌(HCC)的五项获批适应症已进入国家医保药品目录。
2022年第三季度,安进公司授权产品在中国的销售额为1.89亿元,其中包括了
在2022年1月上市的凯洛斯®(注射用卡非佐米)所产生的产品收入;上年同期中国
市场销售额总计1.34亿元。百时美施贵宝授权产品第三季度在中国的销售额为1.53亿
元,上年同期中国市场销售额总计1.69亿元。
公司自主研发的BTK抑制剂百悦泽®已在包括美国、中国、欧盟、英国、加拿大、
澳大利亚、韩国和瑞士在内的58个市场获批多项适应症,其在全球建立了广泛的临
床开发布局,已在超过25个国家和地区入组受试者超过4,700人。2022年上半年公布
的百悦泽®“头对头”对比亿珂®(伊布替尼)用于治疗成人慢性淋巴细胞白血病(CLL)
或小淋巴细胞淋巴瘤(SLL)患者的全球临床三期ALPINE试验的最终缓解评估结果
显示,经独立评审委员会(IRC)确认,百悦泽®在该项适应症中展示了优于伊布替
尼的总缓解率(ORR);2022年10月,在ALPINE试验的终期分析中,经独立评审委
员会(IRC)及研究者评估,百悦泽®在该项适应症中取得无进展生存期(PFS)的优
效性结果,详尽的临床试验结果计划在医学大会进行公布以及在专业文献上发表。
目前,百悦泽®针对该适应症的上市许可申请已获得美国食品药品监督管理局(FDA)
受理。根据《处方药申报者付费法案》(PDUFA),FDA做出决议的目标时间为2023
年1月。2022年11月,百悦泽®用于治疗边缘区淋巴瘤(MZL)患者获得欧盟委员会
批准,标志着百悦泽®成为欧盟地区首个也是唯一一个用于边缘区淋巴瘤(MZL)治
疗的BTK抑制剂。百悦泽®用于治疗慢性淋巴细胞白血病(CLL)患者的新适应症上
市许可申请获得欧洲药品管理局(EMA)受理并获欧洲药品管理局人用药品委员会
(CHMP)积极意见;用于治疗慢性淋巴细胞白血病(CLL)和边缘区淋巴瘤(MZL)
患者的两项新适应症上市许可申请获得英国药品与保健品管理局(MHRA)以及瑞
士药品监督管理局(Swissmedic)受理;用于治疗慢性淋巴细胞白血病(CLL)患者
的补充新药上市许可申请(sNDA)已获加拿大卫生部受理;用于治疗既往接受过至
少一种治疗的华氏巨球蛋白血症(WM)患者获得英国国家卫生与临床优化研究所
(NICE)推荐。此外,中国国家药品监督管理局(NMPA)目前正在审评百悦泽®用
于治疗成人慢性淋巴细胞白血病(CLL)或小淋巴细胞淋巴瘤(SLL)患者新增适应
症上市许可申请,并授予百悦泽®突破性疗法认定。公司致力于做本土创新药出海的
先行者,持续推动自主研发药物的全球化进展,为患者改善治疗效果、提高药物可及性。今年以来,公司已经在10个新增市场实现百悦泽®的商业化上市。
百泽安®目前已在中国获批用于9项适应症,其广泛的全球临床布局包括在30个
国家和地区入组受试者超过11,500人。中国国家药品监督管理局(NMPA)目前正在
审评百泽安®用于一线治疗肿瘤表达PD-L1的晚期或转移性胃或胃食管结合部
(G/GEJ)腺癌患者以及用于一线治疗不可切除的局部晚期、复发或转移性食管鳞状
细胞癌(ESCC)的两项补充新增适应症上市许可申请;公司还就百泽安®用于一线
治疗肝细胞癌患者的补充新增适应症上市许可申请与中国国家药品监督管理局
(NMPA)保持沟通。在澳大利亚和新西兰,百泽安®针对一线和二线治疗非小细胞
肺癌(NSCLC)以及二线治疗食管鳞状细胞癌(ESCC)的新药上市许可申请已分别
获澳大利亚药品管理局(TGA)以及新西兰药品和医疗器械安全管理局(Medsafe)
受理,目前正在审评中;在韩国,百泽安®用于二线治疗食管鳞状细胞癌(ESCC)
的新药上市许可申请已获得食品药品安全部(MFDS)受理,目前正在审评中。继续
支持合作伙伴诺华制药在以下国家和地区监管部门对百泽安®的审评:在美国,百泽
安®针对二线治疗食管鳞状细胞癌(ESCC)的新药上市许可申请已获FDA受理,根
据PDUFA,FDA做出决议的原定目标日期为2022年7月12日,但FDA因新冠肺炎疫情
相关的旅行限制,无法如期在中国完成所需的现场核查工作,因此将延长此BLA的
审批时间,直至现场核查完成。FDA正在持续关注相关公共卫生状况和旅行限制,
因此尚未提供更新的预期决议日期。公司将携手诺华,继续积极配合FDA的审评,
以尽早安排所需的核查工作;在欧盟,百泽安®针对一线和二线治疗非小细胞肺癌
(NSCLC)以及二线治疗食管鳞状细胞癌(ESCC)的上市许可申请(MAA)已获
得欧洲药品管理局(EMA)受理,目前正在审评中;在英国,英国药品与保健品管
理局(MHRA)正在通过“可信赖通道”(Reliance Route)对百泽安®针对一线和二
线治疗非小细胞肺癌(NSCLC)以及二线治疗食管鳞状细胞癌(ESCC)进行审评;
在瑞士,百泽安®针对二线治疗食管鳞状细胞癌(ESCC)的上市许可申请(MAA)
已获得瑞士药品监督管理局(Swissmedic)的受理,目前正在审评中。此外,公司将
继续为合作伙伴诺华制药就计划于2023年提交的百泽安®新适应症上市申请提供支
持,包括在美国递交针对一线治疗肿瘤表达PD-L1的晚期或转移性胃或胃食管结合
部(G/GEJ)腺癌、一线治疗不可切除的食管鳞状细胞癌(ESCC)以及一线治疗肝
细胞癌(HCC)等其他适应症的上市申请。