海思科:创新药HSK16149胶囊上市申请获得受理通知书。
一、获得《受理通知书》的基本情况
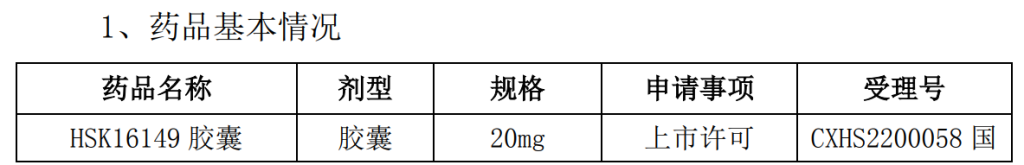
2、HSK16149 胶囊主要情况简介
神经病理性疼痛是由于神经系统受到损伤或产生病变而引起的
疼痛,其主要特征有痛觉过敏、自发性疼痛及异常疼痛,由于病因的
多样性,其发病机制尚未彻底明晰。神经病理性疼痛可分为周围性和
中枢性两种类型,其中糖尿病周围神经痛属于周围性神经病理性疼
痛,其形成机制错综复杂,包括外周敏化、中枢敏化、下行抑制系统
的失能、离子通道的改变等,并且多种机制相互影响。
国内目前已上市的用于治疗周围性神经病理性疼痛的药物主要
为普瑞巴林,但仅批准用于疱疹后遗神经痛的治疗。且因患者头晕、
头痛等中枢不良反应问题,普瑞巴林还需滴定给药,即需先服用小剂量一段时间,耐受后再逐步增加至治疗剂量,存在疗效不佳、不良反
应发生率高等不足。国内目前尚无药物批准用于糖尿病周围神经痛的
治疗,因此,亟需研发新型药物为糖尿病周围神经痛(DPNP)患者提
供安全有效的新治疗选择。
HSK16149 胶囊是由我公司开发的,可以与钙离子通道 α2δ 亚
受体结合,具有自主知识产权的 1 类新药,拟用于周围性神经病理性
疼痛的治疗。本次申报适应症为糖尿病周围神经痛,后续仍将继续开
展其他周围性神经病理性疼痛适应症的临床研究。DPNP 的确证性临
床试验数据统计结果显示,HSK16149 均在统计意义上达到主要疗效
终点。安全性统计结果显示,HSK16149 整体安全性均良好可控。给
药过程无需滴定,有更优的安全性和有效性。
HSK16149 另有一项中国带状疱疹后神经痛患者的Ⅲ期双盲研究
尚在正常推进中。
二、受理注册意义
国家药品监督管理局本次受理 HSK16149 胶囊的上市许可申请,
如该申请顺利通过审批,将能够为创新药的研发积累更为丰富和宝贵
的经验,为公司学术品牌的建立起到积极的推动作用。
三、主要风险提示
由于药品审评周期长、环节多,容易受到一些不确定性因素的影
响,HSK16149 胶囊在新药申请过程中,可能存在由于项目本身、申
报材料质量无法达到评审要求而导致的发补、退审等风险,敬请广大
投资者谨慎决策,注意防范投资风险。