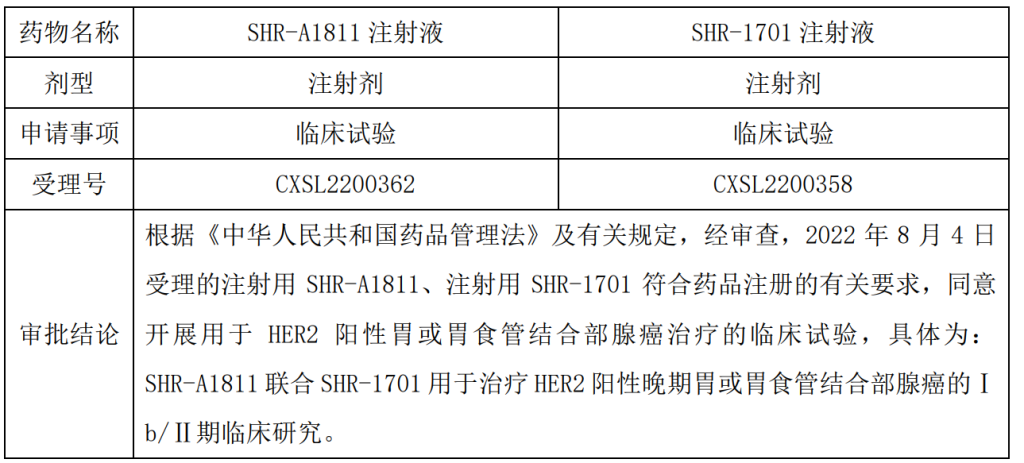
恒瑞医药公告,子公司获得SHR-A1811注射液、SHR-1701注射液药物临床试验批准通知书。
一、 药物的基本情况
二、 药物的其他情况
注射用 SHR-A1811 可通过与 HER2 表达的肿瘤细胞结合并内吞,在肿瘤细胞
溶酶体内通过蛋白酶剪切释放毒素,诱导细胞周期阻滞从而诱导肿瘤细胞凋亡。
经查询,目前国外已上市的同类产品有 Ado-trastuzumab emtansine(商品名
Kadcyla)和 Fam-trastuzumab deruxtecan(商品名 Enhertu)。Kadcyla 由罗
氏公司开发,2019 年国内已进口上市。Enhertu 由阿斯利康和第一三共合作开发。
国内外另有 ARX788、DP303c、A166、RC48、SYD985、BAT8001 等多款产品处于临
床试验阶段。经查询 EvaluatePharma 数据库,2021 年 Kadcyla 和 Enhertu 全球
销售额合计约为 27.52 亿美元。截至目前,注射用 SHR-A1811 相关项目累计已投
入研发费用约 18,178 万元。
SHR-1701 可以促进效应性 T 细胞的活化,同时还可有效改善肿瘤微环境中
的免疫调节作用,最终有效促进免疫系统对于肿瘤细胞的杀伤。SHR-1701 注射
液已在中国开展多项实体瘤临床试验,并在澳洲开展Ⅰ期临床试验。目前国内外
尚无同类产品获批上市,亦无相关销售数据。截至目前,SHR-1701 注射液相关
项目累计已投入研发费用约 34,576 万元。
三、风险提示
根据我国药品注册相关的法律法规要求,药物在获得药物临床试验批准通知
书后,尚需开展临床试验并经国家药监局审评、审批通过后方可生产上市。
药品从研制、临床试验报批到投产的周期长、环节多,药品研发及至上市容
易受到一些不确定性因素的影响,敬请广大投资者谨慎决策,注意防范投资风险。
公司将按国家有关规定积极推进上述研发项目,并及时对项目后续进展情况履行
信息披露义务。